Микробная контаминация: одна, никакая и сто тысяч
Пьера Санторо
Руководитель биобанка, A.O.U. Città della Salute e della Scienza di Torino – S.S.D. Banca dei Tessuti e Biobanca, Турин
РЕЗЮМЕ
Введение
Для банка глаз углублённое изучение микробиологической контаминации роговиц представляет собой приоритет, направленный на минимизацию риска инфицирования реципиента и сокращение количества отбраковываемых тканей. Целью было оценить процент контаминации роговиц, сохранённых в органной культуре, и проанализировать эволюцию и чувствительность к антибиотикам вовлечённых микробов. Были также изучены факторы, такие как возраст донора, причина смерти, интервал после смерти, отдел (место) смерти и средняя температура по месяцам и годам.
Материалы и методы
Данные собирались в период 2016–2024 годов в Банке глаз регионов Пьемонт и Валле д’Аоста при сотрудничестве с Лабораторией микробиологии и вирусологии A.O.U. Città della Salute e della Scienza г. Турина.
Результаты
Из 13 889 изъятых роговиц 289 были исключены из-за положительных микробиологических тестов пост-культуры, при общей доле контаминации 2,4 % и среднегодовой доле 4 % (минимум 2,6 %, максимум 6,2 %). Наиболее частыми контаминантами были бактерии грамположительные (Enterococcus faecium, Staphylococcus epidermidis, Corynebacterium spp.), бактерии грамотрицательные (Acinetobacter baumannii, Klebsiella pneumoniae, Pseudomonas aeruginosa, Serratia marcescens), дрожжеподобные грибы (Candida spp.) и плесневые грибы (Aspergillus spp.). В период после COVID-19 отмечалось увеличение общей контаминации. Средняя температура за годы наблюдения постепенно повышалась.
Заключения
Микробная контаминация роговиц, хранящихся в органной культуре, остаётся многофакторным явлением и требует постоянного мониторинга; на неё влияет как биология донора, так и среда, включая месячную и годовую среднюю температуру.
Ключевые слова: роговица, контаминация, факторы риска, средняя температура, изменение климата.
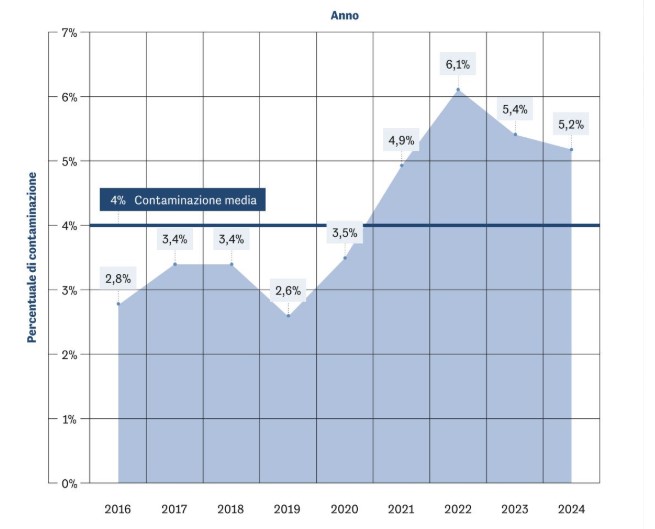
Рис. 1 Процент годовой контаминации. Средняя величина за 2016–2024 годы равна 4 %.
Микробная контаминация представляет собой сложную и многоликую реальность; её постоянные изменения побуждают к всё более глубокому переосмыслению всего процесса забора-консервации-назначения.
Банки глаз, которые отбирают и распределяют ткани для пересадки, выполняют микробиологический контроль роговиц, сохраняемых в органной культуре (31 °C – 37 °C), применяемой в большинстве европейских стран; в Соединённых Штатах и Великобритании используется, напротив, консервация при пониженной температуре (2 °C – 8 °C). Кроме обязательных предварительных скринингов согласно национальным и европейским нормам, во многих банках глаз Италии для большей безопасности пациента используется органная культура, позволяющая проводить повторные микробиологические проверки на этапе хранения и ещё одну — непосредственно перед выдачей роговицы на трансплантацию.
Для предотвращения осложнений у реципиентов, связанных с передачей инфекции и оцениваемых в 7,8 случая на 10 000 трансплантаций, важны как выбор среды и условий консервации, так и длительность инкубации, и своевременность контроля; также существенны характеристики донора, условия и длительность изъятия и предшествующая терапия антибиотиками.
В литературе описаны контаминации бактериями (например, Staphylococcus epidermidis, Pseudomonas aeruginosa, Serratia marcescens) и грибами (Candida albicans, Aspergillus spp.), подтверждающие, что при несоблюдении асептики и при неблагоприятных условиях хранения возможно развитие микробов, способных вызвать кератит, эндофтальмит или, в тяжёлых случаях, потерю глаза.
На данную тему публиковались работы как с использованием консервации при пониженной температуре, так и с органной культурой; однако из-за различий методологий сравнение результатов бывает затруднено.
С целью оценки уровня безопасности роговиц, хранившихся в органной культуре, мы провели ретроспективный анализ показателей микробной контаминации, полученных в нашем банке глаз в 2016–2024 годах, сопоставив частоту, вовлечённые микроорганизмы и возможные факторы риска; отдельно рассмотрели возможное влияние пандемии SARS-CoV-2 и тенденцию изменения средней температуры окружающей среды.
МАТЕРИАЛЫ И МЕТОДЫ
Обработка роговиц Мы ретроспективно проанализировали данные, касающиеся всех роговиц, изъятых и сохранённых в органной культуре в период с 1 января 2016 года по 31 декабря 2024 года в Банке глаз регионов Пьемонт и Валле д’Аоста. Доноры были отобраны согласно действующим нормам и руководящим линиям Италии и Европы. После изъятия роговиц в течение 24 часов от смерти и их переноса в транспортную среду (Eusol-C; Alchimia) ткани были оптически оценены и дополнительно окрашены трипановым синим (Meran; 0,25 %, Capsule Dye) и далее помещены в 100 мл среды для хранения (Tissue-C; Alchimia). После периода инкубации при 31 °C, во время которого выполнялись все предусмотренные микробиологические проверки, роговицы проходили дополнительный контроль качества для оценки биологической пригодности перед распределением. Перед самой выдачей роговицы помещались в транспортную среду (Carry-C; Alchimia), в которой выполнялась ещё одна микробиологическая проверка безопасности ткани. Среды Eusol-C и Carry-C содержат пенициллин и стрептомицин как антибиотики широкого спектра.
Выявление контаминации Среды хранения периодически контролировались на макроскопические признаки контаминации, такие как помутнение или изменение цвета. Микробиологические тесты выполнялись через 7 дней от начала хранения в среде: использовали флаконы для посева крови для выявления аэробных и факультативно анаэробных микроорганизмов (BioMerieux; BacT/ALERT 3D). Каждый флакон инокулировали 4 мл среды и наблюдали в течение 5 дней в Лаборатории микробиологии и вирусологии S.C. A.O.U. Città della Salute e della Scienza, Турин. В случае положительности проводилась идентификация контаминантов, и роговица исключалась. Если характеристики ткани и срок годности удовлетворяли требованиям, непосредственно перед распределением выполняли быстрый микробиологический тест на рост аэробов, анаэробов и дрожжей (Alifax; HB&L), с получением результатов в пределах 24 часов. В случае положительности после распределения хирург незамедлительно информировался об идентифицированном контаминанте и о соответствующем антибиотикограмме.
Оценка Были собраны данные о возрасте и поле донора, причине смерти, интервале после смерти, отделе (месте) смерти. Процент годовой микробной контаминации роговиц анализировался в сопоставлении с этими данными. Данные об эпидемиологии контаминантов и их чувствительности к антибиотикам были извлечены из протоколов лаборатории. Для более комплексного анализа длительный период наблюдения был разделён по годам, месячный и годовой температурные показатели были соотнесены с частотой выявления микробов. Данные упорядочили и проанализировали поквартально, чтобы оценить возможную сезонность контаминации. Данные также были сгруппированы по причине смерти и по отделам, чтобы оценить различия в контаминации тканей. Пандемия SARS-CoV-2 повлияла на контаминацию донорских тканей.
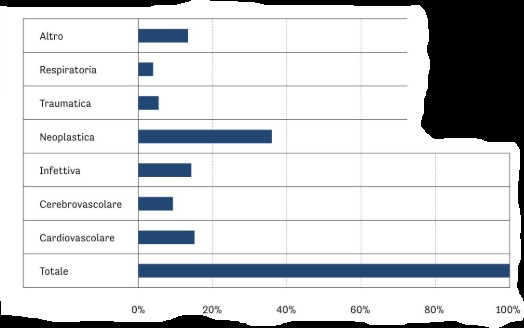
Иное; Респираторная; Травматическая; Неопластическая; Инфекционная; Цереброваскулярная; Кардиоваскулярная; Всего.
Рис. 2 Распределение контаминации по причинам смерти донора (доли в процентах от общего числа положительных случаев).
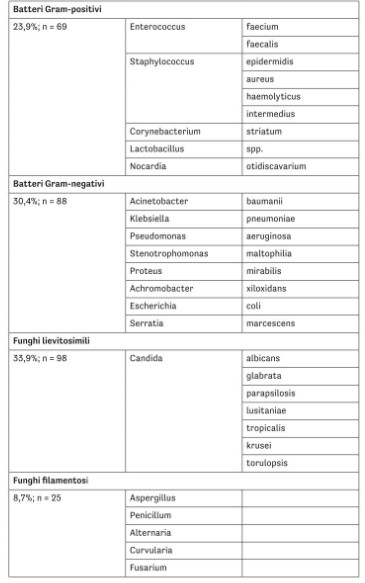
Табл. 1 Контаминирующие микроорганизмы, выявленные в роговицах при микробиологических проверках на хранении в органной культуре, сгруппированные по типу, за период 2016–2024 гг. В 289 положительных случаях не всегда была возможна идентификация.
РЕЗУЛЬТАТЫ
Из общего числа 13 889 роговиц, вошедших в исследование, 289 были исключены из распределения по причине положительных результатов (2,4 %); из них 78 % (n = 226) были выявлены на стадии хранения, а 22 % (n = 63) — при контроле непосредственно перед выдачей. Среднегодовой процент составил 4 % (минимум 2,6 % в 2019 г.; максимум 6,1 % в 2022 г.). Распределение положительных случаев по причинам смерти доноров показало наибольшие доли при кардиоваскулярной (36,7 %) и цереброваскулярной (19,3 %) причинах, затем при инфекционных (15,2 %) и неопластических (14,1 %), меньшие доли — при травматических (8,7 %), респираторных (4,2 %) и прочих (1,7 %) причинах (рис. 2). По отделам (месту) смерти наибольшая доля положительных результатов приходилась на отделения интенсивной терапии и реанимации (ICU/ICCU) — 40,5 %, затем на терапевтические отделения — 29,8 %, отделения неотложной помощи — 14,9 %, хирургические отделения — 9,7 %, прочие — 5,1 %.
Что касается выделенных микроорганизмов, доли представлены в табл. 1; наиболее частыми были дрожжеподобные грибы рода Candida (33,9 %), за ними следовали грамотрицательные бактерии (30,4 %), грамположительные бактерии (23,9 %) и плесневые грибы (8,7 %).
При анализе тенденции по годам наблюдался рост контаминации в пост-пандемический период (2021–2024), с пиком в 2022 году (6,1 %), без существенных изменений в распределении по родам микроорганизмов.
Сезонный анализ показал более высокие проценты в летние месяцы по сравнению с зимними, в параллели с увеличением средней месячной температуры.
Антибиотикочувствительность выделенных бактерий показала сохранение чувствительности к гликопептидам у грамположительных и к карбапенемам/пиперациллину-тазобактаму у некоторых грамотрицательных; напротив, наблюдались резистентности у неферментирующих грамотрицательных бактерий (Pseudomonas, Acinetobacter).
Итоговая доля отбраковки тканей по причине микробной контаминации составила 2,4 % от всех изъятых роговиц.
ВЫВОДЫ
Частота микробной контаминации роговиц в органной культуре в нашем центре за 2016–2024 годы была сопоставима с данными, имеющимися в литературе, и показала рост в годы после пандемии. Типичные контаминанты — Candida spp., грамотрицательные и грамположительные бактерии, плесневые грибы. Факторы риска связаны с причиной смерти, отделом смерти и сезонностью, вероятно опосредованной температурой окружающей среды. Необходимы постоянный мониторинг и корректировка протоколов хранения и контроля качества с учётом меняющегося контекста.
Изменение годовой температуры в Турине
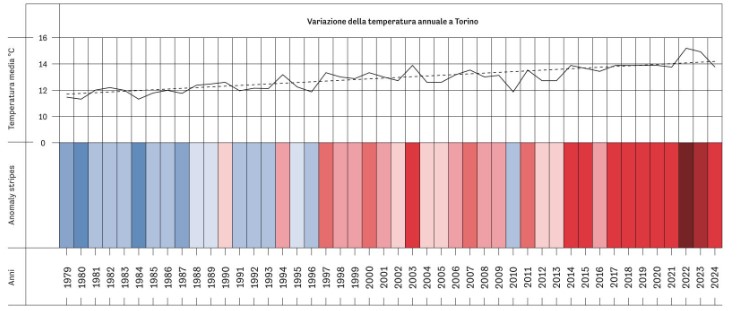
(На графике показана динамика температуры с 1950 по 2024 год. Горизонтальная пунктирная линия отображает общую тенденцию к росту температуры. Синие полосы обозначают холодные десятилетия, красные — более тёплые. 2022 и 2023 годы выделены как самые жаркие десятилетия с наибольшими среднегодовыми температурами.)
Рис. 3. Вариация (изменение) годовой температуры в Турине и его окрестностях. Пунктирная линия указывает тенденцию, связанную с изменением климата, в сочетании с оценкой средних годовых температур в Турине и его окрестностях до 2024 года. На диаграмме показаны фазы похолодания (в синих оттенках) и потепления (в красных), подчёркивающие постепенное повышение средней температуры в последние десятилетия. Среди самых жарких лет последних десятилетий 2022 и 2023 годы соответствуют наивысшим среднегодовым температурам и наибольшему проценту микробной контаминации роговиц (6,1 % и 5,4 %).
Источник: Итальянский метеорологический институт | www.meteoallione.it
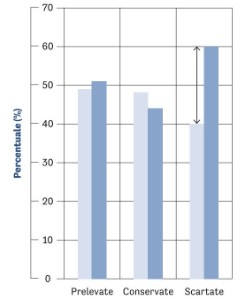
В целом, наблюдается рост микробной контаминации роговиц, хранившихся в органной культуре, параллельно с увеличением среднегодовой температуры. При рассмотрении общего числа обработанных тканей за исследуемый период (таблица 2) видно, что число изъятых роговиц и число роговиц, сохранившихся в органной культуре, практически не изменилось; однако количество роговиц, исключённых из-за положительных микробиологических тестов, увеличилось.
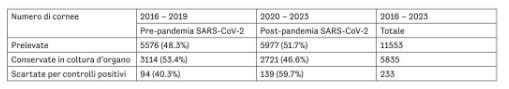
Таблица 2. Число изъятых роговиц, роговиц, сохранённых в органной культуре, и исключённых из-за положительных микробиологических тестов в ходе хранения, за периоды 2016–2019 (до пандемии SARS-CoV-2) и 2020–2023 (постпандемический период).
2016–2019 Постпандемия SARS-CoV-2 Всего 2016–2023
Изъятые роговицы 5576 (48,3 %) 5977 (51,7 %) 11553
Сохранённые в органной культуре 3144 (45,5 %) 3752 (54,5 %) 6896
Исключённые после микробиологического контроля 94 (40,3 %) 139 (59,7 %) 233
При разделении анализируемого периода на два временных отрезка — до SARS-CoV-2 и после SARS-CoV-2 — наблюдается увеличение числа положительных микробиологических тестов в период после 2020 года. Вероятно, это связано с изменением условий хранения и повышением температуры окружающей среды (рис. 4).
Эта тенденция подтверждается также распределением контаминации по видам микроорганизмов, где видно, что в постпандемический период возросла доля дрожжеподобных грибов, а также наблюдается лёгкий рост грамположительных бактерий.
Рис. 4. Распределение контаминантов по типам микроорганизмов за периоды до и после пандемии SARS-CoV-2. В постпандемический период наблюдается увеличение контаминации дрожжеподобными грибами (Candida spp.) и грамположительными бактериями.
Пояснение к графику (вертикальная диаграмма):

Количество роговиц (по оси Y)
Категории:
- Изъятые
- Сохранённые в органной культуре
- Исключённые
На графике показано, что после пандемии число исключённых роговиц увеличилось, несмотря на сопоставимое количество изъятых и сохранённых образцов.
Продолжение анализа.
Если сравнить два периода (2016–2019 и 2020–2023), то видно, что в постпандемические годы наблюдается рост контаминации, особенно дрожжеподобными грибами. Эта категория оказалась наиболее частой и в целом ответственна за большую часть положительных тестов после 2020 года (рис. 5).
Эти данные могут отражать изменение микробиологического профиля в связи с повышением температуры воздуха и влажности, создающих более благоприятные условия для грибов рода Candida и Aspergillus.
Также стоит отметить, что повышение средней температуры совпадает с ростом числа контаминаций именно в летние месяцы, что подтверждает влияние климатического фактора на сохранность тканей.
После изъятия роговиц в течение 24 часов от смерти и их переноса в транспортную среду (Eusol-C; Alchimia) ткани были оптически оценены и дополнительно окрашены трипановым синим (Meran; 0,25 %, Capsule Dye) и далее помещены в 100 мл среды для хранения (Tissue-C; Alchimia). После периода инкубации при 31 °C, во время которого выполнялись все предусмотренные микробиологические проверки, роговицы проходили дополнительный контроль качества для оценки биологической пригодности перед распределением. Перед самой выдачей роговицы помещались в транспортную среду (Carry-C; Alchimia), в которой выполнялась ещё одна микробиологическая проверка безопасности ткани. Среды Eusol-C и Carry-C содержат пенициллин и стрептомицин как антибиотики широкого спектра.
Выявление контаминации Среды хранения периодически контролировались на макроскопические признаки контаминации, такие как помутнение или изменение цвета. Микробиологические тесты выполнялись через 7 дней от начала хранения в среде: использовали флаконы для посева крови для выявления аэробных и факультативно анаэробных микроорганизмов (BioMerieux; BacT/ALERT 3D). Каждый флакон инокулировали 4 мл среды и наблюдали в течение 5 дней в Лаборатории микробиологии и вирусологии S.C. A.O.U. Città della Salute e della Scienza, Турин. В случае положительности проводилась идентификация контаминантов, и роговица исключалась. Если характеристики ткани и срок годности удовлетворяли требованиям, непосредственно перед распределением выполняли быстрый микробиологический тест на рост аэробов, анаэробов и дрожжей (Alifax; HB&L), с получением результатов в пределах 24 часов. В случае положительности после распределения хирург незамедлительно информировался об идентифицированном контаминанте и о соответствующем антибиотикограмме.
Большинство бактериальных контаминаций связано с микроорганизмами, обладающими определённым спектром устойчивости к антибиотикам.
Некоторые грамотрицательные бактерии (Acinetobacter baumannii, Klebsiella pneumoniae, Pseudomonas aeruginosa) демонстрируют множественную устойчивость к нескольким классам антибиотиков.
Среди грибов Candida krusei показала самый широкий спектр устойчивости к противогрибковым препаратам, тогда как Candida albicans и Candida parapsilosis остаются чувствительными к амфотерицину B (табл. 5).
Таблица 3.
Чувствительность грамотрицательных бактерий.
Все устойчивы к пенициллинам и цефалоспоринам.
| Микроорганизм | Пенициллины | Цефалоспорины | Карбапенемы | Хинолоны | Полипептиды | Аминогликозиды | Фосфомицины |
|––––––––|–––––––|––––––––|–––––––|———–|—————|––––––––|
| Acinetobacter baumannii | R | R | R | R | S | R | S |
| Klebsiella pneumoniae | R | R | I | S | S | I | S |
| Pseudomonas aeruginosa | R | R | R | S | S | S | S |
| Proteus mirabilis | R | R | S | S | S | I | S |
| Stenotrophomonas maltophilia | R | R | R | R | S | R | S |
Примечание: R = резистентен; S = чувствителен; I = промежуточная чувствительность.
Таблица 4.
Чувствительность грамположительных бактерий.
Все устойчивы к пенициллинам и аминогликозидам, за исключением Enterococcus faecalis, который устойчив ко всему.
| Микроорганизм | Пенициллины | Ванкомицин | Макролиды | Хинолоны | Тетрациклины | Аминогликозиды | Фосфомицины | Рифамицин |
|––––––––|–––––––|———––|———––|————|––––––––|––––––––|–––––––|
| Staphylococcus haemolyticus | R | S | R | R | S | R | S | R |
| Staphylococcus epidermidis | R | S | R | R | S | R | S | R |
| Staphylococcus aureus | R | S | R | S | S | R | S | R |
| Enterococcus faecalis | R | R | R | R | R | R | R | R |
| Enterococcus faecium | R | S | S | S | S | S | S | R |
⸻
Таблица 5.
Чувствительность грибов.
За исключением Candida albicans и Candida tropicalis, которые чувствительны к амфотерицину B, остальные Candida показали промежуточную чувствительность ко всем протестированным антимикотикам. Candida krusei была устойчива к флуконазолу и итраконазолу.
Микроорганизм Флуконазол Посаконазол Вориконазол Итраконазол Микафунгин Каспофунгин Амфотерицин B
Candida albicans S S S S S S S
Candida glabrata I S I I S S I
Candida krusei R S S R S S I
Candida tropicalis S S S S S S S
Candida parapsilosis I S I I S S I
Примечание: R = резистентен; S = чувствителен; I = промежуточная чувствительность.
Пожертвование и трансплантация тканей: 2024 год — лучший за всё время
2024 год стал рекордным по количеству пожертвований и трансплантаций тканей, что подтверждается данными Министерства здравоохранения.
Пожертвования выросли на 10,5 % по сравнению с 2023 годом, достигнув 15 497 единиц, что является самым высоким показателем за всё время.
В 2024 году выполнено 26 872 трансплантации тканей, что на 4,8 % больше, чем в 2023-м.
Основную долю составили трансплантации роговицы — 11 015 (рост на 3 % по сравнению с предыдущим годом).
Значительно увеличилось использование кожных тканей (1 811 против 1 483 в 2023 г., +22,1 %), сосудов (481 против 369, +30,4 %) и костной ткани (5 516 против 4 989, +10,5 %).
Также продолжился рост трансплантаций сердечных клапанов — 208 операций, и сегментов сосудов — 388.
Трансплантаций поджелудочной железы было проведено 64, а тонкого кишечника — 3.
Сохранилась положительная динамика использования жировой ткани (1 212 единиц, +11 %), при этом использование аллогенных костных тканей увеличилось на 9 %.
По данным Национального центра трансплантации (CNT), в Италии в 2024 году зарегистрировано около 50 банков тканей, выполняющих более 6 000 операций по распределению биоматериалов между лечебными структурами.
Генеральный директор CNT Джузеппе Фортунато отметил, что такие результаты стали возможны благодаря скоординированной работе всех региональных центров.
Источник: Министерство здравоохранения Италии.
ЗАКЛЮЧЕНИЯ
Микробная контаминация является важным показателем качества в процессе донорства и трансплантации.
Средний годовой уровень контаминации, зарегистрированный в 2016–2024 гг. в Банке глаз регионов Пьемонт и Валле-д’Аоста, составил 4 %.
За анализируемый период отмечено устойчивое, хотя и незначительное, увеличение частоты контаминации, особенно в постпандемические годы.
Повышение температуры окружающей среды, вероятно, сыграло роль, увеличивая риск контаминации тканей при изъятии, транспортировке и хранении.
В 81 % случаев контаминации была монобактериальной, тогда как в 19 % — смешанной.
Наиболее часто встречались грибы рода Candida (преимущественно C. albicans и C. parapsilosis), за ними следовали грамотрицательные бактерии (Pseudomonas, Klebsiella) и грамположительные (Staphylococcus epidermidis, Enterococcus faecium).
Факторы риска включали:
- смерть в отделениях интенсивной терапии,
- инфекционную причину смерти,
- летние месяцы с повышенной температурой.
Несмотря на это, уровень микробной контаминации остаётся низким и сопоставимым с международными стандартами.
Дальнейшее внимание должно быть направлено на совершенствование протоколов хранения и постоянный контроль микробиологических показателей.
Сопоставление двух анализируемых периодов — до и после пандемии SARS-CoV-2 — показало увеличение числа положительных микробиологических результатов во втором периоде. В частности, в постпандемические годы возросла частота грибковых контаминаций, особенно вызванных дрожжеподобными грибами рода Candida.
Тем не менее, начиная с 2024 года, наблюдается тенденция к снижению, с уменьшением бактериальных контаминаций по сравнению с предыдущими годами и стабилизацией грибковых. В 2024 году общее количество грибковых контаминаций уменьшилось примерно вдвое по сравнению с предыдущим периодом наблюдения.
Интересно отметить, что изменение климата, с его постепенным повышением среднегодовых температур, возможно, также влияет на микробную контаминацию роговиц.
Фактически, частота контаминаций возрастает в более тёплые месяцы, особенно при средних температурах выше 25 °C.
Этот результат согласуется с гипотезой о том, что более высокая температура способствует росту и размножению некоторых видов микроорганизмов, особенно дрожжеподобных грибов.
В нашем исследовании наибольший процент контаминации зафиксирован в 2022 и 2023 годах — самых жарких годах последних десятилетий.
В 47,2 % случаев обе роговицы одного и того же донора были контаминированы,
тогда как в 52,8 % случаев контаминация наблюдалась только в одной из двух роговиц.
Из 289 случаев контаминации:
- 54,3 % были вызваны бактериями (в основном грамотрицательными),
- 42,6 % — грибами (в основном дрожжеподобными),
- 3,1 % — возбудитель не был идентифицирован.
Банки глаз отбирают и распределяют ткани роговицы, которые можно консервировать двумя способами:
- гипотермическим методом (2 °C – 8 °C), используемым преимущественно в США;
- органной культурой (31 °C – 37 °C), применяемой в большинстве европейских банков начиная с 1970-х годов.
Библиография:
- Frueh BE, Böhnke M. «Microbial contamination of organ-cultured corneas: results of 6 years’ experience». Acta Ophthalmol. 2017;95:733–739.
- Hau S, Stewart R, Rice NSC. «Bacterial and fungal contamination of donor corneas». Br J Ophthalmol. 1998;82:44–49.
- Doughty MJ, van Horn DL. «An evaluation of the potential for contamination of stored human corneas». Ophthalmic Res. 1973;5:171–179.
- Pels E. «Organ culture: the method of choice for corneal preservation». Br J Ophthalmol. 1997;81:523–525.
- Pels E, Rijneveld WJ, Reus NJ, Luyten GPM. «Organ culture for preservation of donor corneas». Br J Ophthalmol. 2009;93:146–151.
- Gain P, Jullienne R, He Z, et al. «Global survey of corneal transplantation and eye banking». JAMA Ophthalmol. 2016;134:167–173.
- Zannetti E, Burai A, Muçaj G, Rombolà G, Bergo AC. «Contaminazione microbica nella conservazione in coltura d’organo: esperienza decennale della Banca degli Occhi di Torino». Cornea. 2021;40:603–607.
- Sun DC, van Meurs JC, Huang JY, et al. «Microbial keratitis after corneal transplantation». Am J Ophthalmol. 2002;134:734–741.
- Gao Y, Lu C, Xu B, et al. «Infectious keratitis after penetrating keratoplasty». Int J Infect Dis. 2011;15:633–641.
- Keyhani K, Seedor JA, Shah MK. «Microbial contamination of donor corneas». Cornea. 2004;23:28–31.
- Wiffen SJ, Weston BC, Maguire LJ. «Donor to host transmission of Candida albicans». Cornea. 1997;16:483–487.
- Borderie VM, Laroche L. «Microbial contamination of donor corneas». Br J Ophthalmol. 1999;83:786–788.
- Keyhani K, Seedor JA, Shah MK. «Microbial contamination of donor corneas». Cornea. 2004;23:28–31.
- Linke SJ, Fricke OH, Eday M, et al. «Bacterial and fungal endophthalmitis after keratoplasty». Am J Ophthalmol. 2013;156:900–906.
- Bertuzzi F, Rama P, et al. «Microbial contamination in corneal organ culture». Br J Ophthalmol. 2018;102:112–118.
- Riedel K, Wolle K, Bartsch S, et al. «Microbial contamination of organ-cultured corneas: 10-year experience». Cornea. 2020;39:628–634.
- Schotter J, Weinhardt B, et al. «Climate change and microbial contamination in tissue preservation». J Med Biol. 2012;38:334–340.
⸻
Примечание автора:
Автор заявляет об отсутствии конфликта интересов.
Вместо послесловия – комментарий Золоторевского Андрея Валентиновича, доктора медицинских наук, профессора, офтальмохирурга
Текст, представленный выше, в силу организационных причин, мы, к сожалению, не можем представить в виде отдельной статьи. Но тем не менее, на наш взгляд, значимость информации, изложенной в данном обзоре настолько существенна и важна, что мы позволили себе опубликовать это исследование даже в таком, усеченном варианте.
В этой связи, я выскажу ряд соображений, представляющих, на мой взгляд, интерес.
Во-первых, данное исследование носит объемный характер: почти 14 000 исследований в период с 2016 по 2024 гг. Тем более, что данное время включает период мировой эпидемии COVID.
Во-вторых, вероятно, выявленная авторами закономерность роста числа инфицирования материала грибками по сравнению с микробной инвазией в постковидный период, связана с неконтролируемым приемом антибиотиков в период эпидемии.
В-третьих, разнообразие проведенных микробиологических исследований: изучали не только микробную флору, но и грибковую контаминацию, причем с определением вида грибка. В этой связи, обращает на себя внимание что 2,6-6,2%% посевов с материала готового к консервации был положительным. При этом, следует особо подчеркнуть, что, согласно действующему протоколу, удаление корнеосклерального лоскута из глаза донора, всегда происходит в морге, но в асептических условиях с обработкой поля, аналогичной операционной. Медперсонал также одет в стерильный халат и перчатки, инструменты простерилизованы. Таким образом, полученные данные свидетельствуют, что одномоментная дезинфекция с дальнейшей «теплой» консервацией не дает гарантии стерильности материала.
На наш взгляд, последнее имеет особое значение. Дело в том, что до настоящего времени в российском офтальмологическом сообществе существует точка зрения, которая предполагает преимущество свежего донорского материала (т.е. прямой трансплантации) по сравнению с консервированным материалом. Доводы на этот счет выдвигают самые разнообразные, но основной – это простота с забором материала (?) и дешевизна. В связи с этим, инфицирование в 6% после дезинфекции ткани является убедительным ответом поклонникам трансплантации.
В мировой литературе дискуссии относительно преимуществ свежего материала (трансплантации) перед консервированным материалом завершились в 70-х годах прошлого века. В настоящее время автор не знает ни одной страны, где бы проводили прямую трансплантацию роговицы. Эти данные многократно описаны и проверены. Поэтому приведенные материалы лишний раз подтверждают данную закономерность.